地址:河南省郑州市高新区长椿路11号国家大学科技园C1A栋
电话:400-717-6600
邮箱:hnrlyczyk@163.com血脑屏障(blood brain barrier,BBB)是存在于血液和脑组织之间的一种特殊生理结构,由脑微血管内皮细胞、基底膜、周细胞和星形胶质细胞等组成 。其主要功能是保护大脑免受病原体、毒素和有害物质的侵入,维持大脑内环境的稳定。BBB具有高度的选择性,它能够严格限制大多数物质的自由通过,只有少数小分子物质和脂溶性物质可以通过被动扩散进入大脑。这种严格的筛选机制虽然对大脑起到了保护作用,但也成为了治疗中枢神经系统疾病药物研发的一大障碍,超过98%的小分子药物和所有大分子药物受到BBB的阻碍无法到达大脑,使中枢神经系统疾病的治疗复杂化。
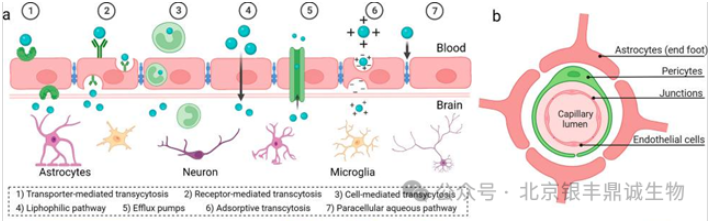
图1 a物质通过BBB的7种机制;b BBB的细胞组成结构(引用自文献2)
1.2 外泌体为什么能穿过BBB
2鼻腔给药外泌体
2.1 鼻腔给与外泌体的药物吸收途径
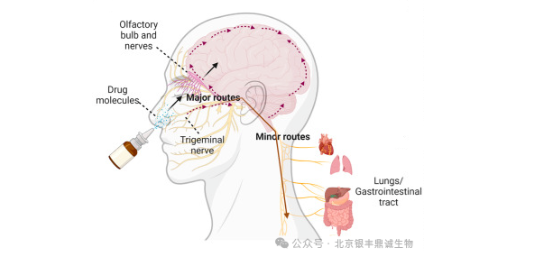
2.2 鼻腔给药的优势
靶向性
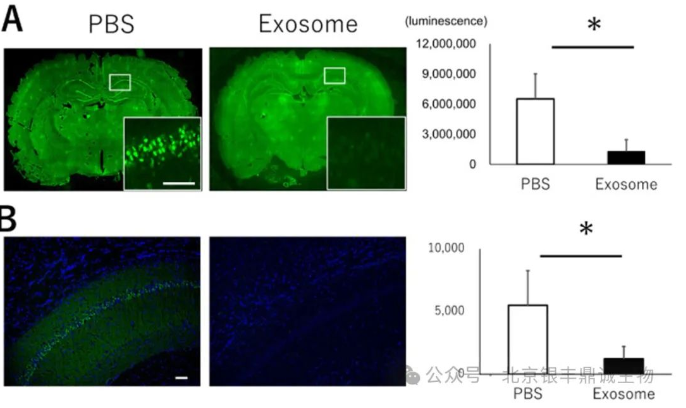
图3TUNEL染色(A图)在第3天对海马CA1区的细胞凋亡情况进行评估,可明显看出外泌体组的凋亡细胞相较于PBS组显著减少;通过Fluoro-JadeC染色(B图)在第7天对神经退行性变进行观察,外泌体组的退行性神经细胞数量也明显少于PBS组(引用自文献3)
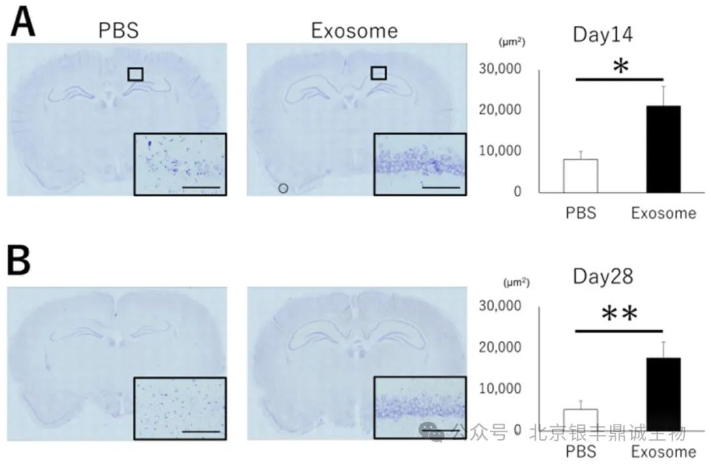
图4 Nissl 染色分别在第 14 天(A 图)和第 28 天(B 图)对海马区神经细胞进行评估,结果显示 PBS 组细胞出现核聚集和结构改变等情况,而外泌体组细胞形态在这些时间点保持相对正常(引用自文献3)
无创无痛
表1 外泌体经鼻给药的临床研究
序号 | 研究名称 | 备案号 | 备案时间 |
1 | 外泌体鼻喷改善血清炎症因子高表达孤独症患儿治疗效果的临床研究 | ChiCTR2400093652 | 2024-12-10 |
2 | 诱导多能干细胞外泌体滴鼻液(GD-iExo-002)治疗儿童癫痫性脑病的探索性临床研究 | ChiCTR2400091107 | 2024-10-21 |
3 | 干细胞外泌体治疗过敏性鼻炎的临床研究(喷鼻治疗) | ChiCTR2400079863 | 2024-01-15 |
5 | Exploring Nasal Drop Therapy With Small Extracellular Vesicles for ALS (de-ALS) | NCT06598202 | 2024-09-10 |
4 | Induced Pluripotent Stem Cell Derived Exosomes Nasal Drops for the Treatment of Refractory Focal Epilepsy | NCT05886205 | 2023-05-08 |
The Pilot Experimental Study of the Neuroprotective Effects of Exosomes in Extremely Low Birth Weight Infants(鼻滴治疗) | NCT05490173 | 2022-07-04 | |
6 | the Safety and the Efficacy Evaluation of Allogenic Adipose MSC-Exos in Patients With Alzheimer's Disease | NCT04388982 | 2020-04-28 |
极低的免疫风险
剂量减少
表2 外泌体经不同方式给药后在各组织的分布情况
给药方式 | 体内分布主要区域 | 离体器官检测主要分布 |
静脉注射(IV) | 小鼠腹部区域,主要在肝脏、脾脏,其次是肺部,肾脏、心脏、大脑组织信号少 | 肝脏、脾脏、肺部有较高荧光信号,肾脏、心脏、大脑组织几乎无信号;肝脏和肠道在组织匀浆荧光分析中信号较高 |
气管内注射(IT) | 胸部区域,24 小时后肺部信号最强 | 肺部信号最强,其他器官无显著信号;肺组织在组织匀浆荧光分析中信号较高 |
鼻内注射(IN) | 脑区域,3 小时和 24 小时均主要位于脑部 | 脑部有特定信号,其次是肺部、肾脏和肠道有低可检测信号;脑组织在组织匀浆荧光分析中信号较低但具有特异性 |
3外泌体治疗各类脑部疾病的研究情况
结语
参考文献
[1] GBD 2021 Stroke Risk Factor Collaborators. Global, regional, and national burden of stroke and its risk factors, 1990-2021: a systematic analysis for the Global Burden of Disease Study 2021. Lancet Neurol. 2024 Oct;23(10):973-1003. doi: 10.1016/S1474-4422(24)00369-7. PMID: 39304265.
[2] Wu D, Chen Q, Chen X, Han F, Chen Z, Wang Y. The blood-brain barrier: structure, regulation, and drug delivery. Signal Transduct Target Ther. 2023 May 25;8(1):217. doi: 10.1038/s41392-023-01481-w. PMID: 37231000; PMCID: PMC10212980.
[3] Wang Y, Niu H, Li L, Han J, Liu Z, Chu M, Sha X, Zhao J. Anti-CHAC1 exosomes for nose-to-brain delivery of miR-760-3p in cerebral ischemia/reperfusion injury mice inhibiting neuron ferroptosis. J Nanobiotechnology. 2023 Mar 27;21(1):109. doi: 10.1186/s12951-023-01862-x. PMID: 36967397; PMCID: PMC10041751.
[4] Tolomeo AM, Zuccolotto G, Malvicini R, De Lazzari G, Penna A, Franco C, Caicci F, Magarotto F, Quarta S, Pozzobon M, Rosato A, Muraca M, Collino F. Biodistribution of Intratracheal, Intranasal, and Intravenous Injections of Human Mesenchymal Stromal Cell-Derived Extracellular Vesicles in a Mouse Model for Drug Delivery Studies. Pharmaceutics. 2023 Feb 7;15(2):548. doi: 10.3390/pharmaceutics15020548. PMID: 36839873; PMCID: PMC9964290.
[5] Li Y, Fang B. Neural stem cell-derived extracellular vesicles: The light of central nervous system diseases. Biomed Pharmacother. 2023 Sep;165:115092. doi: 10.1016/j.biopha.2023.115092. Epub 2023 Jul 4. PMID: 37406512.